
Mediciones de largo plazo utilizando Paraquat en placa de 96 Pocillos Y medio líquido
En este post pretendemos dar un ejemplo de protocolo para realizar experimentos de estrés oxidativo en C.elegans. A continuación, detallamos los pasos para realizarlo:
Pasos para colectar los gusanos:
- Crecer de manera standard C.elegans en placas de NGM provenientes de una sincronización con Hipoclorito de Sodio. 2 placas que contengan 5000 gusanos c/u serán suficientes.
2. Lavar de una placa de agar los gusanos sincronizados en estadio L4 tempranos con solución tampón M9 o agua.
3. Precipitar los gusanos mediante centrifugación, descartar el sobrenadante y agregar 5ml de medio de cultivo líquido. En nuestra experiencia, recomendamos medio 3PY (3% peptona de soja, 3% extracto de levadura) + 50uM FUdR + Antibióticos (estreptomicina 200 ug/ml + Kanamicina 20 ug/ml.)
4. Contar la cantidad de gusanos/5ul y llevar a volumen para obtener una suspensión de 12ml que contenga 35 a 50 gusanos/90 ul de medio de cultivo líquido.
Nota sobre el medio de cultivo: La utilización de fluorodeoxiuridina (FUdR) inhibe el desarrollo embrionario de los gusanos previniendo la eclosión de los huevos. También pueden emplearse cepas de nematodos estériles.
Paso de fraccionamiento e incubación con compuestos:
5. Fraccionar 90ul de la suspensión de gusanos en cada pocillo de la placa de 96 pocillos preferentemente utilizando pipeta multicanal.
6. Añadir 10 μl de los compuestos con potencial poder antioxidante a cada pocillo. utilizar cuadruplicados técnicos en caso de ser posible. Como control positivo puede utilizarse Vitamina C (10 mg/ml).
7. Sellar la placa multipocillo con parafilm® y colocarla a 20 ° C hasta el día siguiente en caso de hacer una preexposición overnight (recomendado).
8. Al día siguiente (post overnight) medir la placa en el WMicrotracker y registrar la actividad por lo menos durante 120 minutos (“Actividad Basal”).
9. Someter a los gusanos al shock de estrés oxidativo: Colocar 11 μl de paraquat, 100 mM, 200 mM y 400 mM y 11 μl de solución tampón K, en pocillos -VitC y + VitC (4 por condición). Volver a sellar la placa.
10. Introducir la placa en el WMicrotracker y registrar la actividad continua durante 6000 min.
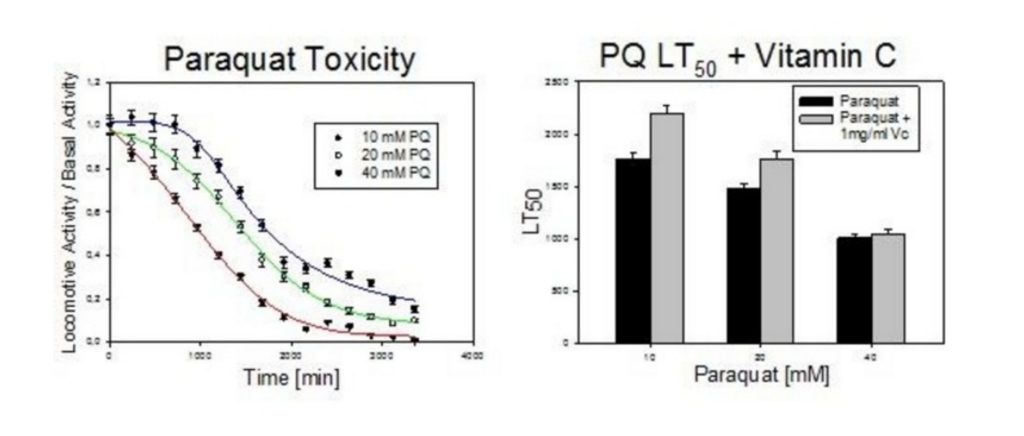
11. Al finalizar, generar el reporte de datos de a bloques de 240 min. Relativizar la actividad reportada frente a la Actividad Basal (matemáticamente dividir cada una de las mediciones por la medición de tiempo 0).
12. Graficar la actividad relativa vs tiempo en excel.
Si todo funcionó bien, deberíamos obtener un gráfico como el que se muestra a continuación:
Por último, es recomendable chequear visualmente las placas a fin de descartar los pocillos que pudieran estar contaminados.
