
La disminución de la actividad locomotora es una lectura robusta para detectar el inicio temprano del envejecimiento. Permite el descubrimiento fácil de nuevos genes y la búsqueda de compuestos para revertir el envejecimiento. En este experimento, mostramos la aplicación de ARENA para medir la actividad de los gusanos en placas de 24 pocillos utilizando medio líquido, y presentamos el protocolo completo para la investigación de la esperanza de vida basada en la motilidad.
MATERIALES:
-Placa de 24 pocillos con tapa
– Gusanos L4 sincronizados (cepa N2).
– Medio S Completo (Ver receta abajo)
– Estreptomicina stock 100 mg/ml.
– Kanamicina stock 100 mg/ml.
– Amfotericina B stock 250 µg/ml.
– bacteria para alimentación OP50 en medio S-completo 100 mg/ml.
– Sistema WMicrotracker ARENA.
METODO:
-Condiciones de esterilidad son necesarias. Utilizar flujo laminar o mechero durante la manipulación de los gusanos.
-Realizar al menos 4 réplicas técnicas con al menos 2 réplicas biológicas.
-Para prevenir la falta de alimento, se requiere suplementar con bacteria. Nosotros suplementamos al día 3, 7, 12, 19, 26.
- Después de la adquisición de datos utilizando wMicrotracker Arena, una rápida inspección de la placa es recomendada para controlar si es necesario suplementar bacteria.
- Remover el film de la placa manteniendo las condiciones de esterilidad.
- Agregar 20 ul de 10 mg/ml de suspensión de bacterias en cada pocillo y volver a colocar el film.
- Agitar la placa cuidadosamente con la mano.
- Guardar la placa en el incubador.
DIA 0_ Transferencia de los gusanos L4 a placas de 24pocillos
– Recoja los gusanos L4 de las placas de agar NGM lavando las placas con medio S completo.
– Ajuste el volumen final para que la concentración de gusanos en la suspensión sea de aproximadamente 100 gusanos / ml .
– Agregue estreptomicina (hasta 200 μg / ml), kanamicina (20 μg / ml) y el medicamento antifúngico Anfotericina B (concentración final 2.5 μg / ml) para evitar la contaminación.
– Agregue un volumen apropiado de bacterias de alimentación en medio S-completo a una concentración final de 3 mg / ml.
– Añadir FUdR a una concentración final de 50 μM.
– Mezcle bien la suspensión de gusanos invirtiendo el tubo varias veces.
– Dispense 500 μL de la suspensión en cada pocillo de una placa de 24 pocillos (50 gusanos/pocillo).
– Selle la placa con un sellador adhesivo transparente (parafilm (R))para evitar la contaminación y la evaporación de las muestras.
– Coloque la placa en la incubadora a la temperatura deseada.
DÍAS 1 a 50. _ Mida la actividad locomotora una vez al día.
-Antes de colocar la placa en el WMicrotracker ARENA, asegúrese de que no haya agua condensada en la tapa de la placa. Si es necesario, seque la tapa de la placa manteniendo condiciones estériles.
– Agite suavemente la microplaca de gusanos con la mano o estimúlelo con luz azul de alta intensidad para inducir el movimiento de los animales antes de comenzar la medición.
– Registre la actividad de la placa con gusanos usando wMicrotracker ARENA durante 30 minutos a la misma temperatura de la incubadora.
-Generar el reporte utilizando el software.
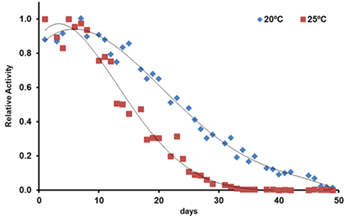
La actividad locomotora de gusanos N2 fue evaluada durante 50 días. Al día 0, larvas L4 fueron transferidas a placas de 24 pocillos conteniendo Medio S Completo con OP50 y 50 µM FudR. Los gusanos fueron crecidos en incubadora , en 2 condiciones, a 20 grados y a 25 grados. La actividad locomotora se midió diariamente por 30 minutos en el sistema WMicrotracker ARENA a la temperatura de crecimiento (20ºC o 25ºC). Se representa la media de la actividad registrada cada día, proveniente de 2 experimentos independientes con 9 réplicas técnicas por grupo.
Receta adicional (del Ian Hope book)
– Medio S-basal:
Para 1 L, agregar:
5.9 g NaCl,
50 mL de Buffer fosfato de potasio 1 M pH 6.0
Ajustar el volumen con ddH2O a 1 L y autoclavar.
Dejar luego enfriar el medio y agregar 1 mL de Colesterol 5 mg/mL (stock disuelto en etanol).
– Medio S-completo:
Para 1 L, agregar:
977 mL de medio S-basal,
10 mL de Citrato de Potaso 1 M pH 6 (esteril)
10 mL Trace metal solution (esteril)
3 mL 1 M CaCl 2 (esteril)
3 mL 1 M MgSO 4 (esteril).
Realizar todo el procedimiento en condiciones de esterilidad, no autoclavar.
