
La enfermedad de Chagas o tripanosomiasis americana es una enfermedad tropical desatendida (NTDWHO), que es endémica en América Latina pero se ha extendido en las últimas décadas a regiones no endémicas debido a la migración de personas infectadas que no lo saben. Su agente etiológico es el parásito protozoario homoflagelado Trypanosoma cruzi (T. cruzi), cuya forma de tripomastigoto metacíclico se transmite al huésped mamífero por chinches de la subfamilia Triatominae, chupadores de sangre. La quimioterapia disponible se basa en benznidazole y nifurtimox, dos medicamentos desarrollados hace más de 50 años, que demostraron ser tóxicos, requieren un tratamiento prolongado en comparación con la tasa de progresión de la enfermedad y, a menudo, desarrollan resistencia a los medicamentos. Aunque se ha analizado la actividad de muchos compuestos naturales y sintéticos contra T. cruzi, muy pocos han progresado con éxito a través de ensayos clínicos. En el trabajo actual, se sintetizó y caracterizó completamente una nueva serie de cinco compuestos [VVO (IN-2H) (L-H)], donde L son derivados de 8-hidroxiquinolina L0-L4 e IN es el nuevo ligando tridentado. Se evaluó la actividad biológica de toda la serie de compuestos de oxidovanadio y los ligandos frente a las formas epimastigota y tripomastigota de T. cruzi. Finalmente, la toxicidad del compuesto se evaluó utilizando Caenorhabditis elegans (C. elegans), un organismo modelo de nematodos que se utiliza para la detección de fármacos como un modelo simplificado de toxicidad animal.
Materiales y Métodos
La cepa Bristol N2 de C. elegans de tipo salvaje y la cepa OP50 de Escherichia coli (E. coli) se obtuvieron del Centro de Genómica de Caenorhabditis (Minneapolis, MN, EE. UU.). Los gusanos se mantuvieron en condiciones estándar a 20°C en placas de agar con medio de crecimiento de nematodos (NGM) sembradas con E. coli OP50 como fuente de alimento. El método utilizado para evaluar la toxicidad se basa en la motilidad del gusano. Brevemente, el sistema de registro de actividad locomotora, WMicrotrackerTM ONE (PhylumTech, Santa Fe, Argentina) detecta interrupciones de microhaces infrarrojos. Los gusanos L4 sincronizados se retiraron de las placas de cultivo y se lavaron tres veces con solución M9 (3 g de KH2PO4; 6 g de Na2HPO4; 5 g de NaCl; 1 ml de 1 MMgSO4 por litro) mediante centrifugación a 1000 g. Los gusanos en M9 DMSO al 1% se sembraron en microplacas de fondo plano de 96 pocillos (Deltalab, Barcelona, España). Se sembraron aproximadamente 70 gusanos por pocillo en 60 µl de M9 conteniendo DMSO al 1% y se midió su movimiento basal durante 30 min para normalizar la actividad de movimiento de cada pocillo al comienzo del ensayo. Luego, se añadió el compuesto [VVO (IN-2H) (L2-H)] disuelto en M9 DMSO al 1% hasta un intervalo de concentración final de 6,5 a 100 µM en un volumen final de 100 µL por pocillo. Se usaron como controles el vehículo DMSO al 1% y el fármaco antihelmíntico ivermectina a 2 µM. Se midió la motilidad utilizando WMicrotrackerTM ONE durante 18 h. La motilidad de los gusanos con vehículo solo después de 18 h se consideró como referencia como motilidad del 100%. Se realizaron cuatro réplicas para cada concentración en placas de 96 pocillos. Se realizaron tres réplicas biológicas.
Resultados
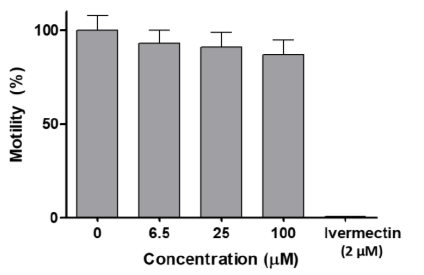
El estudio de dosis-respuesta en C. elegans mostró que [VVO (IN-2H) (L2-H)] no afectó la motilidad del gusano (Figura 9). A una concentración tan alta como 100 µM, que es la solubilidad máxima del compuesto al 1% de DMSO, hubo una disminución minima en la motilidad después de 18 h, que no fue estadísticamente significativa (prueba t no apareada). Por el contrario, el conocido fármaco antihelmíntico ivermectina, utilizado como control positivo, redujo la motilidad a cero a 2 µM (Figura 9). Los gusanos tratados con compuesto [VVO (IN-2H) (L2-H)] a 100 µM o solo con vehículo se recuperaron de los pocillos y se sembraron en placas NGM y se añadió alimento para evaluar la viabilidad y el desarrollo. Los gusanos tratados a 100 µM estaban todos vivos y mostraron un desarrollo normal (L4-gusano adulto-huevo-L1). [VVO (IN-2H) (L2-H)] no afectó significativamente la motilidad después de 18 h de tratamiento en el rango de concentración utilizado (6,5-100 µM). Además, ni la viabilidad ni el desarrollo se vieron afectados después del tratamiento. Estos resultados indican que este compuesto es inocuo para este modelo de invertebrado animal que permite examinar la toxicidad aguda y la toxicidad para el desarrollo y la reproducción (DART).
Heteroleptic Oxidovanadium(V) Complexes with Activity against Infective and Non-Infective Stages of Trypanosoma cruzi. Molecules 2021, 26, 5375.
Scalese, G.; Machado, I.; Salinas, G.; Pérez-Díaz, L.; Gambino, D.
