
En la mayoría de los organismos, la abundancia de lípidos está estrictamente regulada y depende de numerosos estímulos fisiológicos y ambientales. Uno de los principales efectores de la homeostasis lipídica es la proteína quinasa dependiente de AMP cíclico (también conocida como proteína quinasa A [PKA]). La PKA tiene un rol en la respuesta a la inanición en C. elegans, donde la privación de nutrientes da como resultado niveles elevados de AMPc y la consiguiente activación de la PKA. Cuando se activa, la PKA fosforila el ATGL-1, un homólogo del ATGL de los mamíferos, aumentando su actividad lipolítica en la superficie de las gotas de lípidos. Esta enzima es la etapa limitante de la velocidad en la hidrólisis de triglicéridos, y su activación da como resultado la generación de ácidos grasos libres (FFA) para mantener los recursos energéticos durante los períodos de inanición. En C. elegans, las subunidades catalíticas y reguladoras de PKA están codificadas por kin-1 y kin-2, respectivamente. Ambos genes están altamente expresados en las células musculares de la pared corporal, lo que sugiere un papel importante en la regulación del metabolismo muscular. En C. elegans, KIN-1, el ortólogo de la subunidad catalítica de PKA, fosforila directamente ATGL-1 para mejorar la lipólisis y, en consecuencia, reducir las reservas de grasas. Por lo tanto, utilizamos una estrategia basada en RNAi (kin-2 RNAi) para activar constitutivamente PKA / KIN-1 y sus blancos posteriores de activación, incluido ATGL-1. Además, restringimos la respuesta del ARNi a los músculos mediante el uso de una cepa de C. elegans que es sensible al ARNi exclusivamente en las células musculares de la pared corporal (ARNi restringido al músculo [mrRNAi]), lo que nos permite abordar los efectos globales de la señalización de PKA en un único tipo celular.
Materiales y Métodos
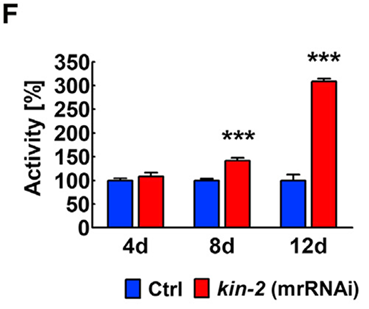
Cuantificación de actividad. La actividad se cuantificó utilizando el equipo WMicroTracker (Wmicrotracker ONE, PhylumTech) basada en la interrupción de microhaces mediada por el movimiento. Después del tratamiento con ARNi posterior a la eclosion durante los días 4, 8, 12, se transfirieron 10 animales por condición a un pocillo de una placa de 96 pocillos conteniendo 200 ul de solución M9 + Tween 20 al 0,01% y se registró la actividad durante 10 horas. Los experimentos se realizaron por triplicado. Los datos se representan como media ± DE. El análisis estadístico se realizó mediante un ANOVA de dos vías y una pos-prueba de Bonferroni (* p <0,05; ** p <0,01; *** p <0,001).
Resultados
En contraste con los efectos de la supresión global de kin-2, encontramos que los animales de mrkin-2 (ARNi) tienen una actividad locomotora mejorada tanto en las etapas jóvenes como en las de mayor edad y son sorprendentemente longevos (Figuras 1F). La activación de PKA exclusivamente en las células musculares confiere efectos que prolongan la esperanza de vida. Esta extensión de longevidad es probablemente una propiedad exclusiva visualizada en músculo ya que no se ha observado esto en ningún otro tipo de célula que investigamos. Además, nuestros datos son consistentes con la PKA que actúa de forma no autónoma en la regulación del envejecimiento del organismo a través de la activación de sus diversos blancos regulados en la cascada.
Cell Rep. 2019 Dec 24;29(13):4540-4552.e8. doi: 10.1016/j.celrep.2019.11.090.
Sebastian Schmeisser, Shaolin Li , Bertrand Bouchard, Matthieu Ruiz, Christine Des Rosiers, Richard Roy.
